Eritropoiesi
L’eritropoiesi è stimolata da un fattore ormonale, di natura glicoproteica, detto eritropoietina (EPO), il cui gene è localizzato sul cromosoma 7; in misura minore è prodot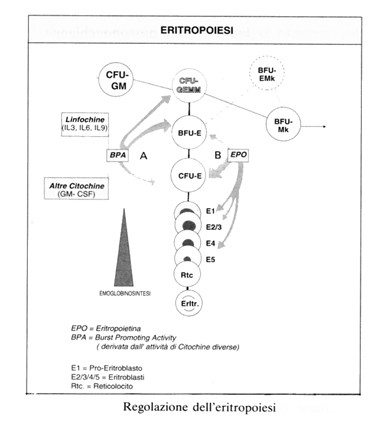 ta anche dal fegato e dal cervello.Quando diminuisce la concentrazione di emoglobina (ad esempio, per anemia) e si abbassa la tensione superficiale di ossigeno nei tessuti, a livello renale le cellule interstiziali peritubulari producono eritropoietina. In realtà non si sa se il rene produce direttamente eritropoietina o eritrogenina, un fattore che reagisce con un substrato proteico plasmatico di origine epatica, detto eritropoietinogeno, per formare eritropoietina attiva.
ta anche dal fegato e dal cervello.Quando diminuisce la concentrazione di emoglobina (ad esempio, per anemia) e si abbassa la tensione superficiale di ossigeno nei tessuti, a livello renale le cellule interstiziali peritubulari producono eritropoietina. In realtà non si sa se il rene produce direttamente eritropoietina o eritrogenina, un fattore che reagisce con un substrato proteico plasmatico di origine epatica, detto eritropoietinogeno, per formare eritropoietina attiva.
In presenza di anemia o ipossiemia, la sintesi renale di eritropoietina aumenta rapidamente di 100 volte o più, i livelli sierici di eritropoietina si alzano e la sopravvivenza, proliferazione e maturazione delle cellule progenitrici midollari viene fortemente stimolata. Questo sensibilissimo meccanismo di feed back può essere interrotto in qualsiasi punto: da una nefropatia, da un danno al midollo o da una carenza di ferro o di vitamine essenziali. In pazienti con stati infettivi o infiammatori, la secrezione di eritropoietina, l’utilizzazione del ferro e la proliferazione dei precursori eritroidi sono tutte inibite dalle citochine infiammatorie.
L’EPO provoca l’immissione in circolo dei reticolociti agendo attivamente sui progenitori eritroidi più maturi, cioè sulle Colonie Formanti Unità-Eritroidi (CFU-E) e sugli eritroblasti (E1 e E2) nonché, meno attivamente, sui progenitori meno differenziati (BFU-E). Sui BFU-E agiscono alcuni fattori a funzione stimolante (BPA), prodotti da fonti diverse: linfociti attivati (IL3, IL4, IL9) e monociti.
La linea eritrocitaria (o serie rossa) è caratterizzata da precursori in via di differenziazione morfologica a partire dal proeritroblasto fino agli eritrociti maturi. I cambiamenti osservabili durante la maturazione degli eritrociti sono l’espressione morfologica della sintesi di emoglobina e dell’involuzione del nucleo.
Le manifestazioni morfologiche più importanti consistono:
- Nella progressiva modificazione delle proprietà tintoriali del citoplasma, dalla basofilia (caratteristica degli stadi immaturi dovuta alla presenza di poliribosomi impegnati nella sintesi di emoglobina) all’acidofilia dipendente dal progressivo accumulo di emoglobina.
- Nelle modificazioni del nucleo che perde i nucleoli e diventa via via più compatto e condensato e quindi più piccolo (picnotico) finché viene espulso.
Tutti gli elementi in via di maturazione fino all’eritroblasto policromatofilo presentano attività mitotica che provvede insieme al continuo commissiona mento di nuove cellule staminali ad assicurare una larga produzione di globuli rossi.
Il processo di differenziazione completo fino all’eritrocito maturo dura 4-5 giorni.
Indice
Proeritroblasto
Il proeritroblasto (E1) è una cellula rotonda, con un diametro di 15-22 µm, con nucleo eucromatico e citoplasma poco abbondante e basofilo, spesso fornito di 1-2 nucleoli.
Eritroblasto basofilo
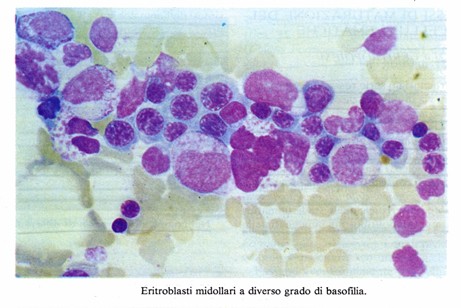
L’eritroblasto basofilo (E2, E3) ha un diametro di circa 15µm. La cromatina è condensata in grosse zolle disposte spesso radialmente; non sono visibili nucleoli. Il citoplasma è abbondante ed intensamente basofilo; presenta un elevato numero di poliribosomi liberi e scarsi elementi di reticolo endoplasmatico, un complesso di Golgi, molti mitocondri e granuli di ferritina. L’attività mitotica è intensa.
Eritroblasto policromatofilo
L’eritroblasto policromatofilo (E4) è caratterizzato dall’involuzione e scomparsa del nucleolo e dalla presenza di zone acidofile nel citoplasma (di colore grigiastro o roseo con il metodo di Giemsa o di Wright) frammiste a zone basofile (di colore blu con i precedenti metodi). La colorazione mista del citoplasma dipende dal progressivo accumulo di emoglobina (sintetizzata sui ribosomi citoplasmatici) che ha una reazione acidofila. Via via che l’emoglobina si accumula, il citoplasma diventa progressivamente acidofilo, le aree basofile (cioè il numero di poliribosomi) diminuiscono, scompare il complesso di Golgi, si riducono i mitocondri e il nucleo diventa più piccolo e più denso. Si passa così per gradi allo stadio successivo.
Eritroblasto ortocromatico
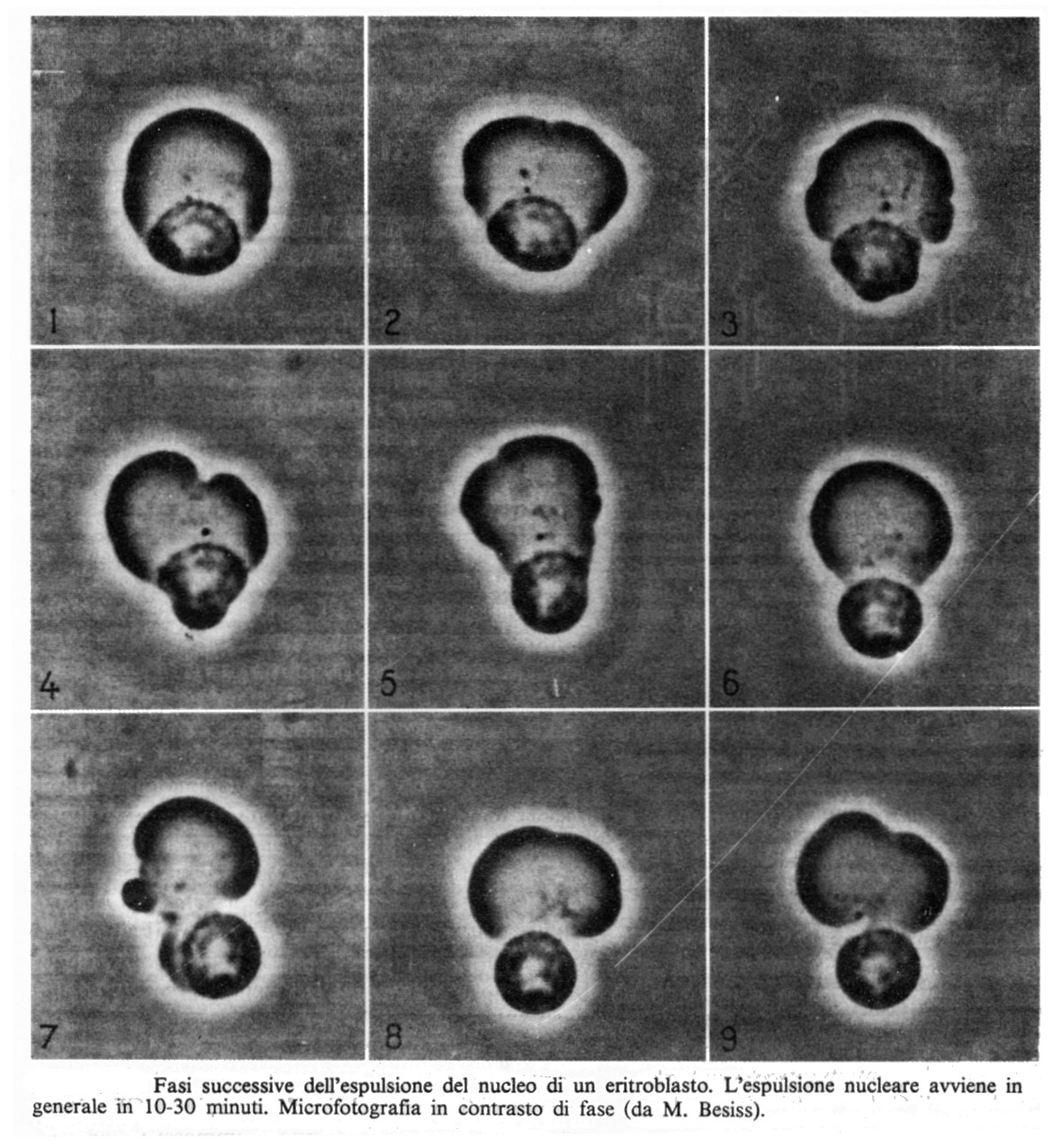
L’eritroblasto ortocromatico (o acidofilo) ha un nucleo piccolo con cromatina molto addensata; il citoplasma mostra intensa acidofilia (ha colore rosso-rosa con il metodo di Giemsa). Negli stadi più avanzati l’attività mitotica si arresta, il nucleo si fa picnotico finché viene espulso dalla cellula che diventa così un eritrocito maturo. Il nucleo espulso è incluso in una sottilissima porzione di citoplasma rivestito da membrana plasmatica; esso è fagocitato dai macrofagi.
Eritrocito maturo
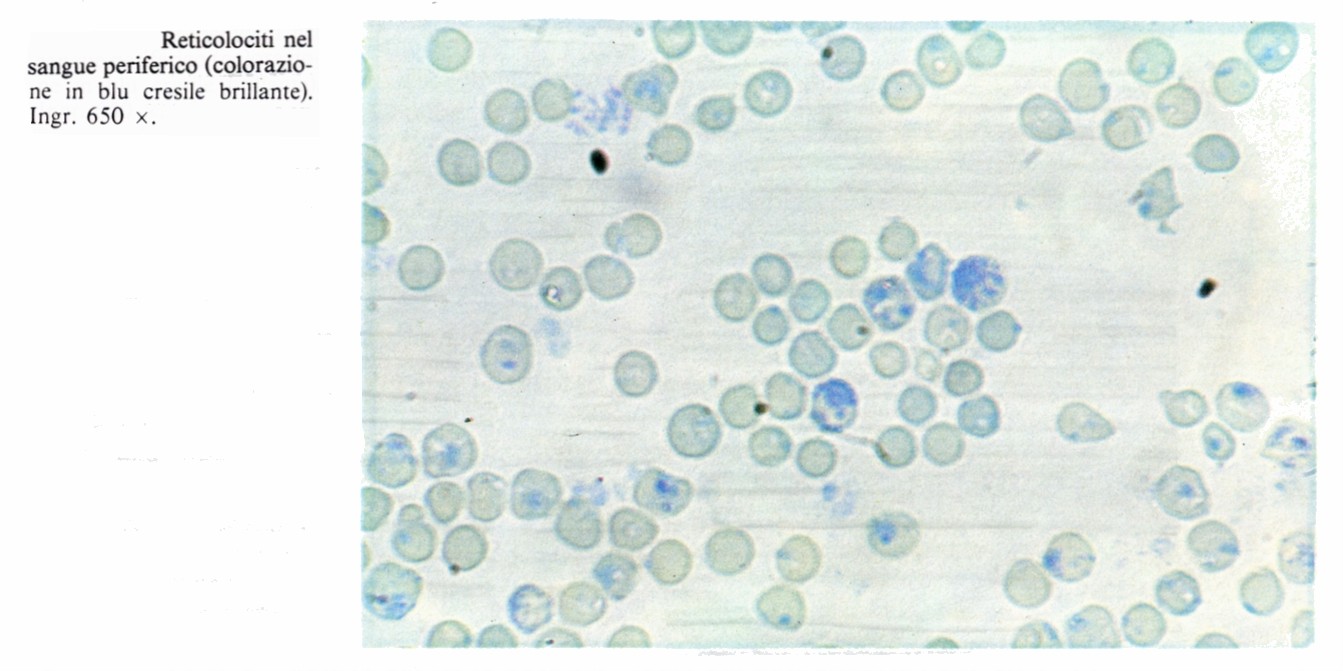
L’eritrocito maturo, attraversando la parete dei sinusoidi, passa nel circolo sanguigno. Gli eritrociti maturi giovani, cioè appena immessi in circolo, conservano per circa 24 ore residui citoplasmatici (ribosomi) che si colorano in blu con il metodo di Giemsa (sostanza policromatofila) e precipitano sottoforma di reticolo con la colorazione vitale al blu-cresile brillante (sostanza granulo-filamentosa). Queste cellule sono perciò dette reticolociti e conservano una residua capacità di sintetizzare emoglobina. I reticolociti rappresentano lo 0,8% di tutti gli eritrociti circolanti ed il loro numero è un indice approssimativo della funzionalità eritropoietina del midollo.
Tutti gli stadi di maturazione dell’eritroblasto contengono ferritina, una proteina complessata con micelle colloidali di sali di ferro, che rappresenta una forma di deposito del ferro utilizzato per la sintesi di emoglobina. La ferritina è costituita da un involucro proteico, l’apoferritina, e da un nucleo formato da micelle di un complesso idrato ferrico-fosfato ferrico. Le molecole di ferritina possono raggrupparsi insieme in aggregati denominati siderosomi, evidenziabili anche con la reazione al blu di Prussia. La ferritina è depositata nelle cellule del sistema reticolo-istiocitario da cui è assunta dagli eritroblasti per micro pinocitosi. Inoltre, è stata identificata una globulina plasmatica coniugata con il ferro, la transferrina, che rappresenta la vera forma di trasporto del ferro. La transferrina non è incorporata nell’eritroblasto ma aderisce alla sua superficie e libera il ferro che penetra nella cellula; nel citoplasma il ferro è utilizzato direttamente per la sintesi di emoglobina oppure si lega a molecole di ferritina, sintetizzate nell’eritroblasto stesso. La ferritina, quindi, sia negli elementi del sistema reticolo-istiocitario, sia negli eritroblasti, funge da forma di deposito del ferro in eccesso.
Terminati i loro 120 giorni di vita, gli eritrociti attraversano la parete delle venule postcapillari e sono fagocitati dalle cellule del sistema reticolo-istiocitario, particolarmente nella milza, nel fegato e nel midollo.
L’emoglobina viene rapidamente degradata: la sua componente proteica (globina) è idrolizzata in aminoacidi; il ferro si stacca dall’eme e si trasforma nel pigmento biliare bilirubina che passa nel plasma dove si lega all’albumina. La bilirubina è quindi captata dal fegato, coniugata all’acido glucuronico e secreta con la bile nel duodeno. Il ferro è complessato in gran parte con la proteina ferritina e in parte minore con l’emosiderina.
Il ferro depositato nei macrofagi può liberarsi dalla sua associazione con le proteine di deposito ed essere trasportato per mezzo della transferrina al midollo osseo dove viene riutilizzato per la produzione di nuova emoglobina.
I macrofagi della milza, del fegato e del midollo rappresentano i più importanti depositi di ferro dell’organismo. Il ferro contenuto nella dieta è trasportato in questi organi per via ematica in associazione con la transferrina.