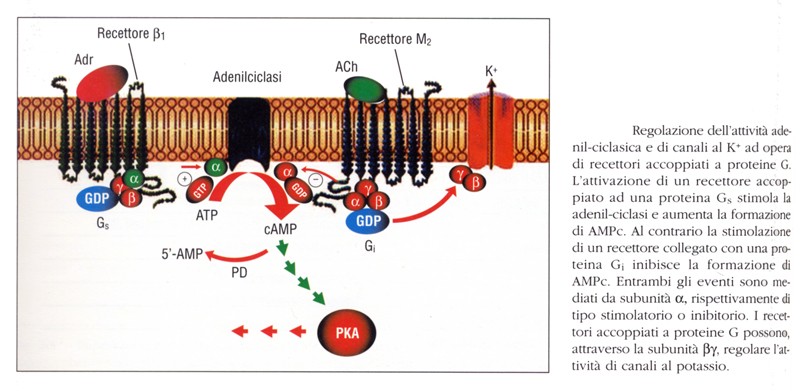
Via dell’adenilato-ciclasi
L’adenilato-ciclasi è un enzima di membrana, con sito attivo rivolto verso il citoplasma, formato da due domini M (M1 ed M2), ciascuno dei quali formato da 6 eliche transmembrana, e due sequenze intracellulari contrassegnate da C1 e C2 che rappresentano due siti di legame per le subunità αs-GTP e αi-GTP. Lo stesso enzima, quindi, può avere effetti di attivazione o inibizione a seconda del tipo di subunità α.
Quando l’effettore adenilato-ciclasi è attivato da una subunità αs, produce come secondo messaggero l’AMP-ciclico (cAMP –si legge lettera per lettera, non “camp”–), generato a partire dall’ATP. Il cAMP è una molecola relativamente piccola, solubile in acqua, che può diffondere rapidamente attraverso il citoplasma.
Gli effetti del cAMP sono mediati attraverso l’attivazione della protein-kinasi A (PKA); il cAMP, inoltre, media anche effetti su recettori-canale che riconoscono ed agganciano tale molecola regolando così il flusso ionico.
Le proetin-kinasi A (A = attivata da AMP ciclico) sono costituite da 2 siti regolatori e da 2 siti catalitici. Due molecole di cAMP si legano ai siti regolatori e tale legame libera le subunità catalitiche che possono agire sui vari substrati citoplasmatici o traslocano nel nucleo dove controllano la trascrizione genica mediante l’attivazione di fattori di trascrizione quali CREB (cAMP responding element binding protein).
Quando le PKA sono inattive, sono legate alle proteine di ancoraggio (AKAP = A kinase anchoring protein).
Il cAMP è responsabile di numerosi effetti:
- Attivazione della glicogenolisi e della lipolisi.
- Attivazione dei canali cationici del calcio.
- Regolazione della trasduzione di geni specifici legandosi a sequenze specifiche del promotore.
- Rilasciamento delle cellule muscolari lisce(il cAMP attraverso l’attivazione delle protein-chinasi, causa fosforilazione della chinasi della catena leggera della miosina che così si trova nello stato inattivo e quindi, a sua volta, non può più fosforilare la catena leggera della miosina che sarà perciò impossibilitata ad unirsi all’actina).
- Esocitosi.
I secondi messaggeri devono agire in tempi brevi perciò esistono dei meccanismi intracellulari responsabili della loro degradazione che avviene grazie a una fosfodiesterasi dei nucleotidi ciclici che forma il 5′-adenosin-monofosfato (5’AMP).
Un altro interruttore per lo spegnimento del segnale è costituito dalle serina/tiroina protein-fosfatasi che staccano specificamente i gruppi fosforici trasferiti sulle proteine dalle protein-chinasi.
Infine, l’attivazione della risposta del recettore si può concludere anche con l’endocitosi dei recettori e delle loro molecole-segnale. Dopo l’endocitosi il recettore può essere degradato dai lisosomi o può essere rimosso dai suoi segnali extracellulari e riciclato sulla superficie cellulare.
Le fosfodiesterasi possono essere bersaglio di farmaci: ciò serve a mantenere alta la concentrazione di cAMP. Un esempio di questi farmaci sono rappresentati dalle xantine (caffeina, teofillina, teobromina). Le xantine sono anche potenti antagonisti per il recettore della xantina che concorre al meccanismo di broncodilatazione. L’aminofillina è usata come broncodilatatore perché attraverso le fosfodiesterasi mantiene alto il livello intracellulare di cAMP che causa il rilasciamento della muscolatura bronchiale. Ci sono fosfodiesterasi (di tipo 3) presenti a livello di miocardiociti che sono bersaglio di amrinone e milrinone; questi farmaci, mantenendo alto livello di cAMP nei miocardiociti causano attivazione dei canali al calcio con conseguente ingresso di calcio nella cellula che è così responsabile degli effetti inotropi positivi.
Le proteine G che funzionano secondo la via dell’adenilato-ciclasi sono bersaglio di tre note tossine batteriche:
- Tossina colerica, secreta da Vibrio cholera.
- Tossina della pertosse, prodotta da Bordetella perussis.
- Tossina prodotta da alcuni ceppi di Escherichia coli.
Tutte e tre le tossine modificano le proteine G rendendole permanentemente attive, con conseguente aumento di cAMP. Di conseguenza, le vie metaboliche controllate dal cAMP presentano livelli di attività elevati e senza alcun controllo.
Articolo creato il 25 febbraio 2010.
Ultimo aggiornamento: vedi sotto il titolo.