Matrice organica dell’osso
La matrice organica dell’osso è rappresentata da fibre collagene (con la caratteristica periodicità assile di 68-70 nm al microscopio elettronico) incluse in una sostanza amorfa costituita da proteoglicani e da glicoproteine. Dal punto di vista qualitativo è simile a quella del tessuto cartilagineo, ma le differenze si notano dal punto di vista quantitativo: la concentrazione di proteoglicani (con catene laterali costituite da condroitin solfato e cheratan solfato) è molto bassa (0,2-1% rispetto alla cartilagine in cui è del 35-40%) di modo che il collagene (di tipo I) diventa prevalente rispetto agli altri costituenti. Per questo motivo la matrice ossea è acidofila ed Alcian blu-negativa mentre quella cartilagine è fortemente basofila, metacromatica ed Alcian blu-positiva. L’osso si colora inoltre con la reazione PAS per i polisaccaridi, per il suo contenuto in glicoproteine.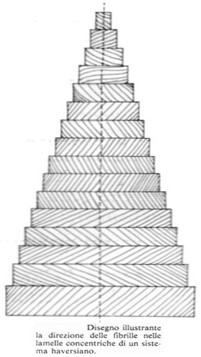
Con la miscela ematossilina-eosina l’osso si colora in rosso mentre la cartilagine rimane incolore.
La distribuzione delle fibre collagene e delle cellule ossee può essere studiata solo nei preparati decalcificati, cioè privati dei Sali inorganici. Ciò può essere ottenuto trattando l’osso con un acido debole o con un agente chelante, come l’acido etilendiaminotetracetico (EDTA). Nei preparati non decalcificati le fibre collagene sono mascherate dall’abbondante matrice minerale che ha lo stesso indice di rifrazione ed appaiono come una massa omogenea acidofila.
I sali inorganici sono disposti ordinatamente tra i fascetti di fibre collagene, attorno alle singole fibrille ed anche all’interno delle fibrille tra le microfibrille. Dopo asportazione dei Sali di calciosi può rilevare che i fasci di fibrille sono disposti in maniera ordinata parallelamente tra loro in ciascuna lamella. I fasci collageni decorrono ad elica rispetto all’asse dell’osteone in ciascuna lamella, ma il passo dell’elica (cioè l’osteone) e la direzione delle fibre variano secondo angoli molto diversi nelle lamelle contigue. La direzione e l’inclinazione delle fibre sono invece grossolanamente regolari e costanti nell’ambito di una singola lamella. In conclusione, nell’osteone si alternano lamelle le cui fibre hanno un andamento destrorso ed una particolare inclinazione e lamelle aventi fibre con direzione sinistrorsa ed inclinazione diversa. Questo comportamento è la ragione del fatto che nelle sezioni trasversali dei sistemi di Havers si alternano spesso lamelle striate e lamelle punteggiate. Nelle prime le fibre decorrono più o meno parallelamente al piano della sezione e sono tagliate longitudinalmente; nelle lamelle punteggiate le fibrille sono disposte perpendicolarmente od obliquamente al piano della sezione e sono sezionate trasversalmente al loro asse maggiore.
Siccome le fibrille collagene sono birifrangenti, se sezioni trasversali di osteoni sono osservate con il microscopio a luce polarizzata, si osservano lamelle luminose (con fibre decorrenti sul piano di sezione) alternate a lamelle oscure (con fibre colpite perpendicolarmente al loro asse maggiore). L’alternanza di strie luminose ed oscure è interrotta da una croce oscura che corrisponde ai settori nei quali le fibre decorrono parallelamente alla direzione di vibrazione del nicol.
Oltre le fibre lamellari, negli strati esterni dell’osso si osservano i grossi fasci di fibre perforanti di Sharpey provenienti dal periostio.
La matrice organica dell’osso contiene, oltre al collagene di tipo I (ne rappresenta il 90%), anche varie classi di macromolecole.
- Proteoglicani Composti da glicosaminoglicani acidi, solitamente solforati, uniti assieme da brevi catene proteiche. Quelli meglio conosciuti sono:
- Proteoglicano di tipo I (PG-I), detto anche biglicano in quanto costituito da due molecole di condroitinsolfato unite ad una estremità da un polipeptide ricco di leucina; lo si ritrova sia nella sostanza intercellulare mineralizzata che in quella non mineralizzata adiacente alle cellule ossee e ai loro prolungamenti, il cosiddetto tessuto osteoide.
- Proteoglicano di tipo II (PG-II), detto anche decorina in quanto tende ad associarsi alle microfibrille collagene come a decorarle. È formato da una parte proteica analoga a quella del PG-I unita ad una sola molecola di condroitinsolfato. Lo si ritrova nella sostanza intercellulare mineralizzata ma non nel tessuto osteoide, per cui si ipotizza che abbia un ruolo nell’orientare la deposizione dei cristalli minerali lungo le micro fibrille collagene.
- Glicoproteine Di solito fosforilate o solfatate, includono molecole diverse alcune delle quali sono ritenute giocare un ruolo fondamentale nel controllo dei processi di mineralizzazione. Tra queste si annoverano:
- Osteonectina, la glicoproteina più abbondante (costituisce il 3% della matrice organica). È dotata di alta affinità per il calcio, sia come ione libero che associato in complessi di tipo cristallino. Si ritiene che essa agisca come elemento di nucleazione dei cristalli minerali, in quanto ritenuta capace di concentrare il calcio nelle sue adiacenze creando così le condizioni per avviare la precipitazione del fosfato di calcio. Si lega al collagene e all’idrossiapatite
- Fosfatasi alcalina, un enzima capace di idrolizzare gruppi fosfato legati a substrati organici (come il piridossal-5-fosfato) attivo in ambiente alcalino (pH 8-10). Essa potrebbe giocare un ruolo nei processi di mineralizzazione, mettendo a disposizione gli ioni fosfato per la formazione dei cristalli minerali, oppure sarebbe invece coinvolta nella sintesi della matrice organica dell’osso.
- Fibronectina Molecola di adesione localizzata prevalentemente nella matrice pericellulare e caratterizzata da una porzione capace di legarsi al collagene. Si ritiene che la fibronectina sia coinvolta nei processi di migrazione, adesione alla matrice e organizzazione delle cellule dell’osso.
- Sialoproteine, o BSP (bone sialo-proteins) Sono glicoproteine peculiari contenenti residui glicidici di acido sialico. Queste proteine posseggono una sequenza aminoacidica particolare Arg-Gly-Asp (sequenza RGD) che media l’adesione al substrato di svariati tipi cellulari, incluse le cellule dell’osso. Si ritiene pertanto che le sialoproteine ossee abbiano la funzione fisiologica di consentire l’adesione delle cellule alla matrice ossea. Se ne conoscono più tipi: osteopontina (o BSP-I), la BSP-II e la glicoproteina acida dell’osso (o BAG-75).
- Proteine contenenti l’acido g-carbossiglutammico (GLA), un aminoacido particolare derivato dall’acido glutammico con un ulteriore gruppo carbossilico legato al carbonio in posizione g. Il GLA incluso in una proteina possiede, nella porzione del residuo, due gruppi carbossilici liberi e ravvicinati che a pH fisiologico sono ionizzati e carichi negativamente, e pertanto capaci di agire come una sorta di chelanti per i cationi bivalenti quali lo ione calcio. Le proteine dell’osso contenenti il GLA sono di due tipi: osteocalcina (presenta un’elevata affinità di legame per l’idrossiapatite), o proteina GLA dell’osso, una piccola proteina contenente 3-5 residui di GLA. È stato ipotizzato che essa possa giocare un ruolo di inibizione della mineralizzazione in quanto ritenuta capace di legarsi allo ione calcio e di renderlo indisponibile per la combinazione con lo ione fosfato, inibendo così l’accrescimento dimensionale dei cristalli minerali. Questa ipotesi è avvalorata dalla constatazione che l’osteocalcina abbonda nel tessuto osseo maturo ed è invece scarsa nel tessuto osseo in via di formazione, nonché dal reperto che questa proteina inibisce la crescita di cristalli di fosfato di calcio in vitro.
Proteina GLA della matrice è presente sia nell’osso maturo che in quello in via di formazione, nonché nella cartilagine destinata a essere sostituita da tessuto osseo, come la cartilagine di accrescimento. Il suo ruolo biologico non è chiarito.
Articolo creato il 4 marzo 2010.
Ultimo aggiornamento: vedi sotto il titolo.


