Miosina
La miosina è una proteina filamentosa lunga 1,5 µm e larga circa 2 nm. È formata da una porzione allungata (o coda) e da due estremità globose (o teste). La molecola completa è un esamero costituito da due identiche subunità pesanti appaiate e da quattro subunità leggere uguali due a due. Le subunità pesanti compongono la coda e partecipano insieme alle subunità leggere a formare le due teste della struttura della molecola. Ciascuna testa contiene due molecole di subunità leggere diverse tra loro.
Mediante una breve digestione con enzimi proteolitici, la miosina può essere spezzata in due parti denominate meromiosina leggera (MML), priva di attività ATP-asica, e meromiosina pesante (MMP), provvista di attività ATP-asica e della capacità di legare l’actina (eventi necessari per la contrazione muscolare).
La meromiosina leggera è formata da un segmento delle due catene polipeptidiche pesanti appaiate ed avvolte a spirale l’una sull’altra.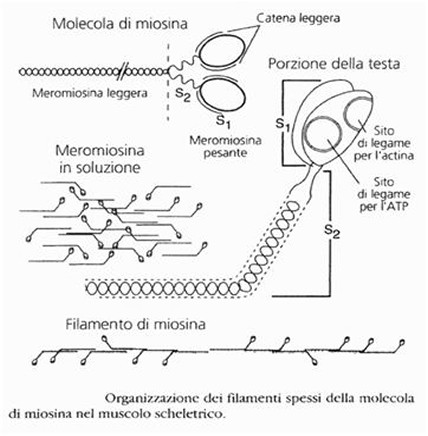
La meromiosina pesante comprende la testa della molecola ed una parte della coda che si continua con la MML.
Il frammento pesante può essere ulteriormente scisso, mediante un trattamento enzimatico più prolungato, nei due subframmenti “testa” e “coda”.
- La testa (o subframmento S1) è formata dalle quattro catene leggere e dai frammenti terminali delle due catene pesanti e conserva tutta l’attività ATPasica della miosina, nonché la capacità di combinarsi con l’actina per formare l’actomiosina.
Alla regione S1 sono associate due catene di peptidi:- La catena leggera essenziale permette alla miosina di funzionale.
- La catena leggera regolatoria può essere fosforilata e partecipa alla modulazione della funzione muscolare.
- La coda (o subframmento S2) è composta da segmenti delle due catene pesanti che si continuano con quelle della restante parte della coda della molecola. Questo subframmento serve da braccio flessibile tra la testa e la coda della molecola.
Le molecole di miosina funzionali sono accoppiate; la coda e le regioni S2 sono piegate l’una verso l’altra lungo tutta la loro lunghezza e le loro teste sono adiacenti fra loro. In questo modo la molecola esiste sottoforma di dimero funzionale.
L’unione di due dimeri di miosina implica una compattazione delle molecole di miosina tale che le regioni della coda formano il sostegno dei miofilamenti spessi e quelle della testa si estendono all’esterno a forma di elica. Nel senso della circonferenza del filamento, ogni 60° sporge una testa di miosina, distante dalla precedente 14,4 nm nel senso della lunghezza di esso.
Inoltre, le molecole di miosina sono impacchettate nel filamento spesso in modo da trovarsi giustapposte per le estremità delle code nel segmento centrale di esso e da estendersi con le teste verso le due estremità opposte, da cui risulta al centro del filamento una zona priva di teste di miosina protrudenti.
Articolo creato l’8 marzo 2010.
Ultimo aggiornamento: vedi sotto il titolo.

