Recettori accoppiati a proteine G
I recettori accoppiati a proteine G sono dei recettori di membrana (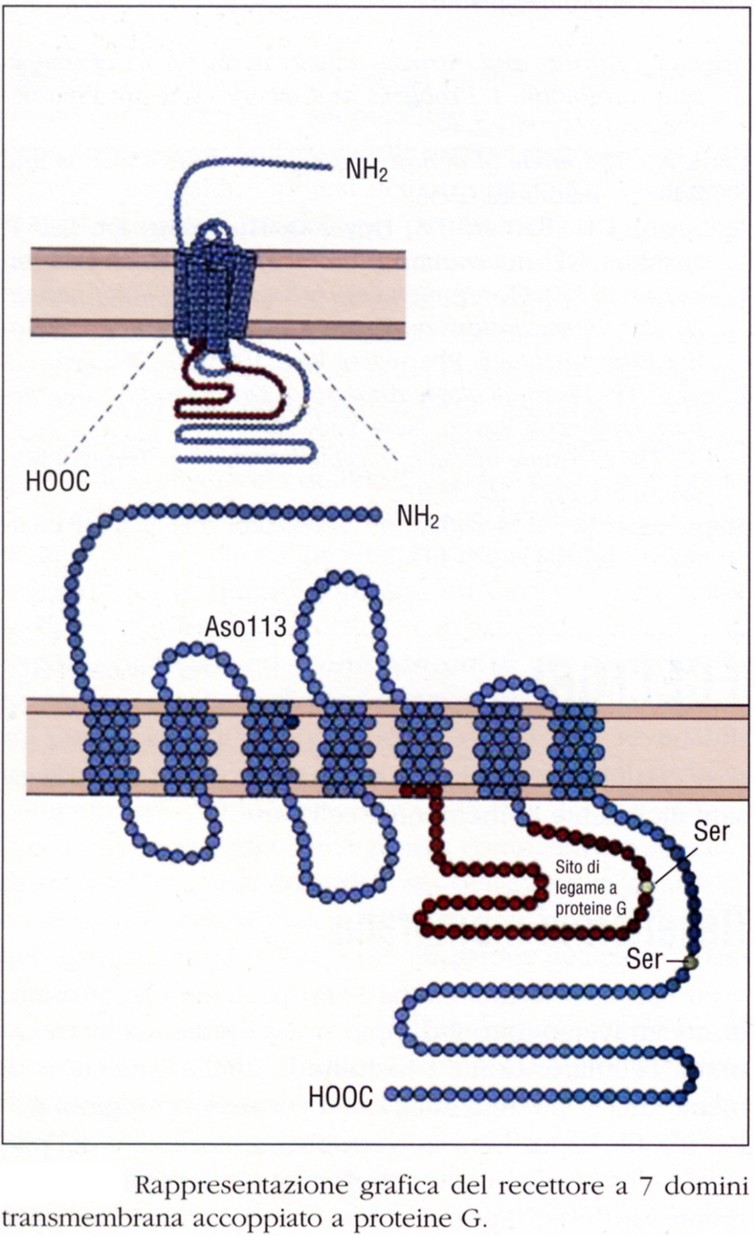 o di superficie) che mediano i loro effetti attraverso l’attivazione di una proteina G, quindi attraverso una cascata di eventi biochimici che portano alla formazione dei secondi messaggeri all’interno della cellula; a causa della lunga sequenza di eventi, rispetto ai recettori-canale la tramissione è meno rapida.
o di superficie) che mediano i loro effetti attraverso l’attivazione di una proteina G, quindi attraverso una cascata di eventi biochimici che portano alla formazione dei secondi messaggeri all’interno della cellula; a causa della lunga sequenza di eventi, rispetto ai recettori-canale la tramissione è meno rapida.
Strutturalmente sono composti da un’unica catena polipeptidica formata da 7 alfa-eliche che attraversa 7 volte la membrana plasmatica. A queste 7 alfa-eliche si aggiungono 6 anse idrofiliche (3 extracellulari e 3 citoplasmatiche) di collegamento fra le alfa-eliche.
L’estremità amino-terminale è extracellulare, quella carbossi-terminale è intracellulare. L’ansa intracitoplasmatica che collega la 5a e la 6a elica transmembarana (cioè la 3a ansa intracellulare), insieme ad un dominio della regione C-terminale, forma il sito di legame per le proteine G. Questa stessa ansa e la coda C-terminale, inoltre, hanno degli aminoacidi di serina e treonina che rappresentano i siti di enzimi fosforilanti importanti per la modulazione e la desensitizzazione di questi recettori.
Questi recettori si aggregano a formare particelle globulari nella membrana e in seguito al legame con il ligando (neurotrasmettitore o agonista in genere) dimerizzano.
I siti di riconoscimento per i ligandi (neurotrasmettitori, ormoni peptidici e farmaci agonisti ed antagonisti) si trovano o sulla porzione N-terminale o in tasche formate dal raggruppamento delle porzioni transmembrana.
Articolo creato il 6 marzo 2010.
Ultimo aggiornamento: vedi sotto il titolo.


