Coagulazione del sangue
La coagulazione del sangue è la terza fase dell’emostasi che interviene per arrestare il sanguinamento in caso di danni di grave entità della parete vasale per i quali non è sufficiente la sola formazione del tappo piastrinico (seconda fase dell’emostasi). Nel sangue e nei tessuti sono state finora trovate più di 50 diverse sostanze capaci di influenzare la coagulazione del sangue, alcune promuovendola, procoagulanti, altre inibendola, anticoagulanti. Normalmente il sangue non coagula dentro i vasi per la prevalenza degli anticoagulanti, ma ove si determini rottura di un vaso sanguigno l’attività dei procoagulanti nella sede della lesione aumenta in misura tale da portare alla formazione del coagulo.
Il processo di coagulazione si svolge in 3 stadi essenziali: formazione dell’attivatore della protrombina, conversione della protrombina in trombina da parte dell’attivatore della protrombina in presenza di ioni calcio e azione della trombina sul fibrinogeno (o fattore I) trasformandolo in filamenti di fibrina (o fattore Ia).
Indice
Formazione dell’attivatore della protrombina
In risposta a rottura di un vaso o ad alterazione del sangue stesso si verifica un insieme di reazioni che coinvolge più di una dozzina di fattori di coagulazione. Il risultato finale è la formazione di una serie di sostanze attivate, cui si dà il nome comune di attivatore della protrombina.
L’attivatore della protrombina è il promotore della conversione della protrombina (o fattore II) in trombina (o fattore IIa) e scatena i successivi stadi della coagulazione. Si considera generalmente che l’attivatore della protrombina si formi attraverso due vie fondamentali, benché in realtà esse interagiscano costantemente l’una con l’altra:
– La via estrinseca, che origina dal trauma della parete vasale o dei tessuti circostanti.
– La via intrinseca, che inizia nel sangue stesso.
In entrambe queste vie esplicano le funzioni di principale rilievo una serie di proteine plasmatiche, specialmente le beta-globuline. Queste, insieme con gli altri fattori che partecipano al processo della coagulazione, si chiamano fattori della coagulazione del sangue e sono per la massima parte forme inattive di enzimi proteolitici. Quando vengono convertiti nelle forme attive, essi promuovono la successione di reazioni del processo della coagulazione. I fattori della coagulazione, per la maggior parte, vengono indicati con numeri romani; quando si vuole segnalare che un determinato fattore si trova nella forma attiva, si aggiunge una “a” minuscola dopo il numero romano (ad esempio, il fattore VIIIa indica la forma attiva del fattore VIII).In seguito a rottura di vasi sanguigni la coagulazione viene avviata da entrambi i sistemi simultaneamente. La tromboplastina tessutale dà inizio alla via estrinseca, mentre il contatto del fattore XII e delle piastrine con il collagene della parete vasale avvia la via intrinseca. Una differenza di particolare rilievo fra il meccanismo intrinseco e quello estrinseco è che quest’ultimo ha un carattere esplosivo; una volta avviato, la velocità di evoluzione è limitata soltanto dalla quantità di tromboplastina tessutale liberata dai tessuti traumatizzati e da quella dei fattori X, VII e V presenti nel sangue. Se il trauma tessutale è grave, la coagulazione può attuarsi in appena 15 secondi. Al contrario, il meccanismo intrinseco è molto più lento, richiedendo di solito da 1 a 6 minuti prima di determinare la coagulazione.
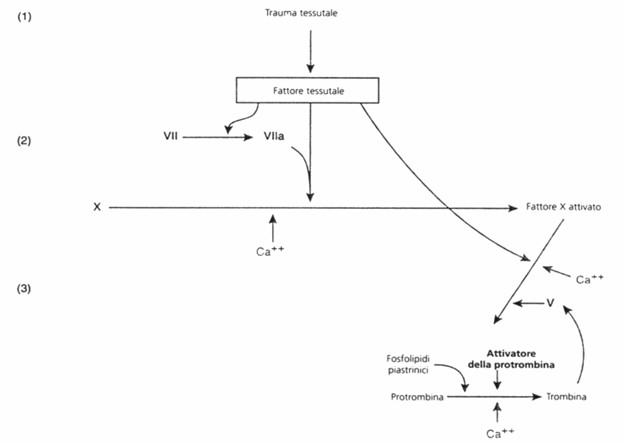
Via estrinseca della coagulazione
La via estrinseca della coagulazione per la formazione dell’attivatore della protrombina comincia con un trauma della parete vasale o dei tessuti extravasali e si svolge attraverso le seguenti fasi:
a. Liberazione di fattore tessutale. Il tessuto traumatizzato libera un complesso di vari fattori detti tromboplastina tessutale (o fattore III). Questa comprende in particolare fosfolipidi dalle membrane dei tessuti e un complesso lipoproteico contenente un enzima proteolitico.
b. Attivazione del fattore X. Il complesso lipoproteico del fattore tessutale si unisce a costituire un nuovo complesso con il fattore VII della coagulazione, e in presenza di ioni calcio (fattore IV) agisce enzimaticamente sul fattore X formando il fattore X attivo.
c. Azione del fattore X attivo per la formazione dell’attivatore della protrombina. Il fattore X attivo si unisce immediatamente coi fosfolipidi disponibili che fanno parte della tromboplastina tessutale o che vengono liberati dalle piastrine, nonché con la proaccelerina (o fattore V), formando il complesso designato come attivatore della protrombina. Questo, nel giro di pochi secondi scinde la protrombina liberando trombina. Dapprima, il fattore V nel complesso attivatore protrombinico è inattivo; ma una volta che la coagulazione ha inizio e comincia a venire formata trombina, l’azione proteolitica della trombina attiva il fattore V; questo quindi diventa un ulteriore forte acceleratore dell’attivazione della protrombina. Pertanto, nel complesso finale attivatore della protrombina, il fattore X attivato è la proteasi che provoca effettivamente la scissione della protrombina in trombina, il fattore V attivato accelera notevolmente questa attività proteasica ed i fosfolipidi agiscono come veicolo che accelera ulteriormente il processo. Si osservi in particolare l’effetto feedback positivo della trombina, che agisce attraverso il fattore V, nell’accelerare l’intero processo una volta che ha avuto inizio.
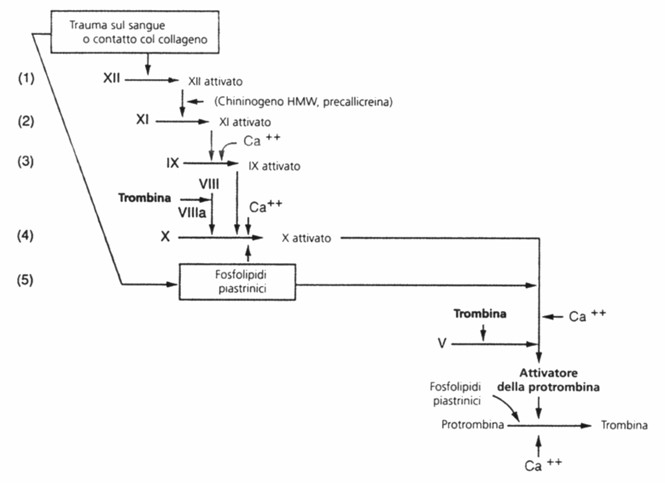
Via intrinseca della coagulazione
La via intrinseca della coagulazione ha inizio con un trauma sul sangue stesso o con l’esposizione del sangue al collageno di una parete vasale traumatizzata e procede poi lungo la seguente serie di reazioni a “cascata”:
a. Attivazione del fattore XII (o fattore di Hageman)e liberazione di fosfolipidi piastrinici. Un trauma sul sangue o l’esposizione del sangue al collageno della parete vasale modifica due importanti fattori della coagulazione presenti nel sangue, il fattore XII e le piastrine. Quando il fattore XII è alterato, come per contatto con collageno o con una superficie bagnatile, come il vetro, esso assume una nuova configurazione e diventa attivo. Simultaneamente, il trauma sul sangue altera anche piastrine, per adesione al collageno o ad una superficie bagnabile, (o per danno di altro genere), e conseguentemente le piastrine liberano fosfolipidi tra cui la lipoproteina chiamata fattore piastrinico III, che pure ha un ruolo nelle reazioni successive.
b. Attivazione del fattore XI (o fattore antecedente plasmatico della tromboplastina). Il fattore XII attivato agisce enzimaticamente e attiva il fattore XI. Questa reazione richiede anche chininogeno ad alto peso molecolare (HMW), e viene accelerata dalla precallicreina.
c. Attivazione del fattore IX (o fattore di Christmas). Il fattore XI attivato agisce successivamente con meccanismo enzimatico sul fattore IX, che viene così attivato. Questa reazione richiede ioni calcio.
d. Attivazione del fattore X (o fattore di Stuart). Sempre in presenza di ioni calcio, il fattore IX attivato, agendo di concerto con il fattore VIII, con i fosfolipidi piastrinici e con il fattore III liberato dalle piastrine traumatizzate, attiva il fattore X (o fattore di Stuart). È chiaro che in caso di scarsa disponibilità di fattore VIII o di piastrine, questo stadio viene meno. Il fattore VIII è quello che manca nei soggetti affetti da emofilia classica e viene perciò designato come fattore antiemofilico.
e. Formazione dell’attivatore della protrombina. Questo stadio nel meccanismo intrinseco è uguale all’ultimo stadio del meccanismo entrinseco. Ossia, il fattore X attivato si unisce al fattore V ed ai fosfolipidi piastrinici o tessutali formando il complesso noto come attivatore della protrombina. Alla fine l’attivatore della protrombina, nel giro di pochi secondi, determina la scissione della trombina dalla protrombina ed avvia il processo della coagulazione, come precedentemente descritto.
Salvo che nei primi due stadi del meccanismo intrinseco, gli ioni calcio sono necessari per lo svolgimento di tutte le reazioni. Perciò, in assenza di ioni calcio la coagulazione del sangue non può aver luogo. Va rilevato che nell’organismo vivente la concentrazione degli ioni calcio raramente cade a livelli tanto bassi da influire significativamente sulla cinetica dell’emocoagulazione. D’altra parte, il sangue prelevato da un individuo può essere reso incoagulabile riducendo la concentrazione dei ioni calcio al di sotto del livello minimo richiesto per la coagulazione. Ciò si può ottenere provocando sia la deionizzazione del calcio, facendolo reagire con ioni come il citrato, sia la sua precipitazione con sostanze come lo ione ossalato.
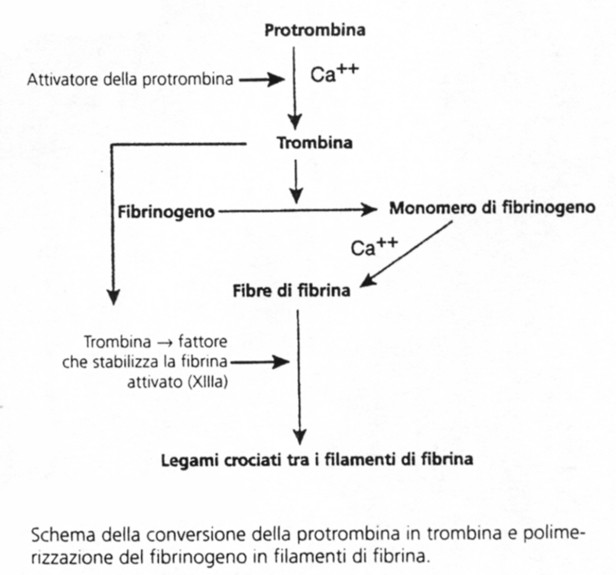
Conversione della protrombina in trombina da parte dell’attivatore della protrombina in presenza di ioni calcio
Le piastrine svolgono un ruolo chiave nella conversione della protrombina in trombina poiché la maggior parte delle molecole di protrombina si lega ai propri recettori presenti sulla superficie delle piastrine legate al tessuto danneggiato. Questo legame accelera la trasformazione di protrombina in trombina, che avviene proprio nel tessuto dove è richiesta la formazione del coagulo.
Azione della trombina sul fibrinogeno (o fattore I) trasformandolo in filamenti di fibrina (o fattore Ia)
La fibrina costituisce il coagulo nel cui reticolo restano intrappolate le piastrine, le cellule ematiche ed il plasma. Questa fase dura solo 10-15 secondi, quindi il fattore che limita la velocità del processo della coagulazione del sangue è di solito la formazione dell’attivatore della protrombina e non le reazioni che ad essa fanno seguito, poiché queste normalmente si svolgono assai rapidamente fino alla formazione del coagulo.
Il coagulo formatosi durante l’emocoagulazione è composto da una struttura reticolare costituita da filamenti di fibrina che diramandosi in tutte le direzioni intrappolano cellule ematiche, piastrine e plasma. I filamenti di fibrina aderiscono alle superfici lese dei vasi sanguigni sicché il coagulo stesso, aderendo ad ogni punto della lesione vasale, impedisce l’emorragia.
Pochi minuti dopo la formazione del coagulo, questo comincia a contrarsi spremendo dalla sua massa la maggior parte del liquido, di solito in 20-60 minuti. Il liquido espresso dal coagulo si chiama siero: questo differisce dal plasma perché in esso mancano il fibrinogeno e la maggior parte degli altri fattori della coagulazione. Ovviamente, il siero non può più coagulare proprio per la mancanza di tali fattori. Perché avvenga la retrazione del coagulo sono necessarie le piastrine. Una mancata retrazione del coagulo, perciò, è indice di una diminuzione del numero di piastrine nel sangue circolante. L’esame di coaguli sanguigni al microscopio elettronico mostra che le piastrine sono attaccate ai filamenti di fibrina in modo da collegare effettivamente tra loro diversi filamenti.
Le piastrine intrappolate nel coagulo continuano a liberare sostanze procoagulanti, una delle quali è il fattore XIII (o fattore stabilizzante la fibrina), che determina un numero sempre più elevato di legami crociati tra i filamenti di fibrina adiacenti. Inoltre, le piastrine stesse contribuiscono direttamente alla contrazione del coagulo attivando le molecole piastriniche di trombostenina, di actina e di miosina, che sono proteine contrattili e provocano una forte contrazione delle spicule piastriniche attaccate alla fibrina. Ovviamente, ciò favorisce anche la compressione della rete di fibrina in una massa di minori dimensioni. La contrazione è attivata o accelerata dalla trombina come pure dagli ioni calcio liberati dalle scorte di calcio nei mitocondri, nel reticolo endoplasmatico e nell’apparato di Golgi delle piastrine. Con la retrazione del coagulo, i lembi della parete vasale rotta vengono ad accostarsi l’uno all’altro, potendo così contribuire alla fase finale dell’emostasi.
Una volta che ha cominciato a prodursi un coagulo sanguigno, generalmente esso tende nel giro di pochi minuti ad estendersi al sangue circostante. Il coagulo stesso, cioè, dà inizio ad un circolo vizioso (feedback positivo) che favorisce ulteriormente la coagulazione. Una delle più importanti cause di questo fenomeno è che l’azione proteolitica della trombina si esplica, oltre che sul fibrinogeno, anche su molti altri fattori della coagulazione sanguigna. Per esempio, la trombina ha un effetto proteolitico diretto sulla stessa protrombina, contribuendo così a formare nuove molecole di trombina, ed altri effetti su alcuni fattori della coagulazione sanguigna responsabili della formazione dell’attivatore della protrombina. Questi effetti comprendono: l’accelerazione dell’azione dei fattori VIII, IX, X, XI, XII e l’aggregazione piastrinica. Così, una volta formatasi una certa quantità critica di trombina, s’instaura un circolo autoalimentato per cui si forma altra trombina ed il coagulo continua a crescere. Ovviamente il coagulo non può continuare ad espandersi all’infinito e ciò è possibile grazie alla presenza delle sostanze anticoagulanti del sangue:
- Filamenti di fibrina.
- Antitrombina III (o cofattore antitrombina-eparina).
- Eparina.
- alfa2-macroglobulina.
Sostanze anticoagulanti
I filamenti di fibrina sono formati durante il processo di coagulazione; mentre il coagulo è in via di formazione, circa 1’85-90% della trombina viene adsorbita dai filamenti di fibrina, a mano a mano che essi si formano. Ciò ovviamente concorre ad impedire la diffusione della trombina nel resto del sangue e non permette quindi un’eccessiva estensione del coagulo.
La trombina che non viene adsorbita dai filamenti di fibrina si combina con l’antitrombina III (o cofattore antitrombina-eparina) che in tal modo blocca l’azione della trombina sul fibrinogeno e poi inattiva, nei successivi 12-20 minuti, la trombina legata.
L’eparina ha una concentrazione ematica normalmente molto bassa così che solo in alcune condizioni fisiologiche esercita un significativo effetto anticoagulante. Di per sé ha una proprietà anticoagulante minima o nulla, ma quando si combina con l’antitrombina III aumenta sino a cento-mille volte l’efficacia di questa sostanza nel rimuovere la trombina, agendo così come anticoagulante. Pertanto, in presenza di un eccesso di eparina la rimozione della trombina dal sangue circolante da parte dell’antitrombina III è quasi istantanea.
Il complesso di eparina ed antitrombina III rimuove oltre alla trombina anche vari altri fattori della coagulazione attivati, esaltando così ulteriormente l’efficacia dell’effetto anticoagulante. Questi altri fattori comprendono i fattori XII, XI, IX e X.
I mastociti sono estremamente abbondanti nel tessuto che circonda i capillari dei polmoni e in minor grado nei capillari del fegato; è facile capire perché grandi quantità di eparina possono essere necessarie in queste aree, giacché i capillari dei polmoni e del fegato ricevono molti coaguli embolici formati nel sangue venoso che fluisce lentamente attraverso questi organi; una sufficiente formazione di eparina può prevenire un’ulteriore crescita dei coaguli.
L’α2-macroglobulina è una globulina di grandi dimensioni che, come l’antitrombina III, si combina con i fattori proteolitici della coagulazione. La sua attività, però, non viene accelerata dall’eparina. La sua funzione è principalmente quella di combinarsi con vari fattori della coagulazione inattivandoli fino a quando non vengano in vario modo distrutti, ma non ad opera della stessa α2-macroglobulina. È probabile che questa sostanza abbia anche normalmente una parte importante nell’impedire la coagulazione del sangue.