Composizione molecolare della sostanza amorfa
I costituenti chimici più importanti della sostanza fondamentale dei tessuti connettivi appartengono ad una classe eterogenea di sostanze denominate glicosaminoglicani (GAG) che legandosi a proteine formano grossi complessi proteico-polisaccaridici detti proteoglicani. La sostanza amorfa contiene anche, in concentrazioni minori, glicoproteine. Infine, essa è costituita da acqua, sali inorganici, enzimi, ormoni, vitamine e quantità variabili di tropocollagene libero.
I componenti macromolecolari della sostanza amorfa sono prodotti dai fibroblasti nel tessuto connettivo propriamente detto, dai condroblasti nella cartilagine e dagli osteoblasti nel tessuto osseo. La sede di sintesi è l’apparato di Golgi nel quale avviene anche la solfatazione dei glicosaminoglicani e la loro coniugazione alla componente proteica prodotta sui ribosomi.
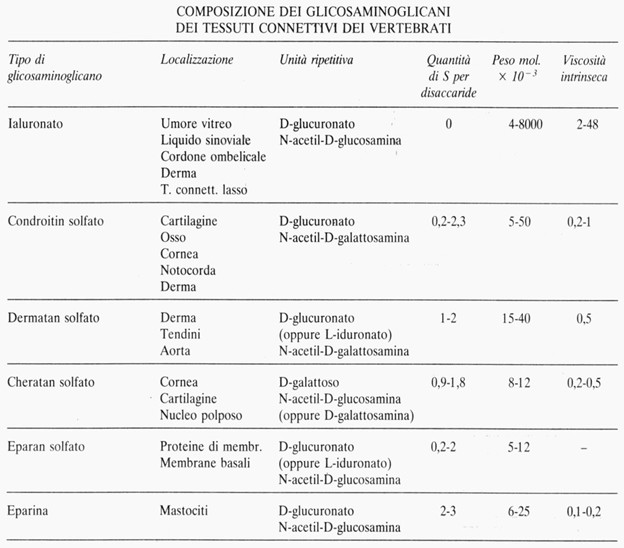
I glicosaminoglicani (GAG) dei tessuti connettivi sono lunghe catene polimeriche formate da un concatenamento lineare di unità disaccaridiche identiche unite linearmente tra loro da legami O-glicosidici. Tra questi figurano soprattutto l’acido D-glucuronico e gli amino-zuccheri glucosamina e galattosamina che possono essere acetilati (N-acetil-glucosamina e N-acetil-galattosamina) o solforati (N-solfato-glucosamina e N-solfato-galattosamina). Quando nella molecola sono presenti elevate quantità di acido solforico e di acido glucuronico, i GAG sono fortemente acidi.
I GAG non solforati sono l’acido ialuronico e l’acido condroitinico.
I GAG solforati sono il condroitin solfato A, il condroitin solfato C, il dermatan solfato (o condroitin solfato B), il cheratan solfato e l’eparan solfato.
Anche l’eparina è un glicosaminoglicano con un contenuto di acido solforico abbastanza alto.
I GAG in soluzione e nei tessuti sono ionizzati e possono quindi essere considerati come polielettroliti polianionici; come tali possono legare cationi inorganici ed organici nonché proteine. La natura delle molecole legate ai GAG influenzano notevolmente la conformazione della catena che è molto flessibile e può passare dalla forma distesa a quella strettamente attorcigliata con conseguente mutamento della viscosità della soluzione.
La viscosità della sostanza amorfa dei tessuti connettivi, quindi, dipende in larga misura dai mutamenti conformazionali dei GAG e in particolare, nel tessuto connettivo lasso, dall’acido ialuronico. A tale proprietà si deve soprattutto la consistenza della sostanza fondamentale e la sua permeabilità ai liquidi interstiziali. Per esempio, il liquido sinoviale delle articolazioni contiene elevate quantità di acido ialuronico e perciò risulta essere viscoso e avente proprietà lubrificante.
- L’acido ialuronico è il GAG più abbondante del tessuto connettivo lasso. L’unità disaccaridica che si ripete è formata da acido glucuronico e N-acetil-glucosamina.
La viscosità dell’acido ialuronico dipende da:
- Il suo grado di polimerizzazione.
- La sua conformazione tridimensionale.
- La capacità di legare l’acqua.
Tali proprietà possono modificarsi rapidamente in rapporto alle condizioni funzionali, determinando variazioni parallele della consistenza della matrice amorfa e della diffusione di sostanze dai capillari ai tessuti e viceversa.
L’acido ialuronico svolge quindi un ruolo fondamentale nel controllare la diffusione nel tessuto connettivo di sostanze disciolte nei liquidi interstiziali (prodotti nutritivi, ormoni, anticorpi, ecc.) e nel prevenire la diffusione di agenti tossici e di batteri nelle infezioni localizzate.
La ialuronidasi è un enzima prodotto da alcuni batteri, presente nel veleno di alcuni serpenti e nel testicolo, che idrolizza specificamente l’acido ialuronico riducendo la sua viscosità con conseguente aumento della permeabilità del tessuto connettivo.
- I condroitin solfati si trovano nei tessuti come componenti dei proteoglicani. Nella cartilagine e in altri tessuti, come il connettivo dell’aorta, la maggior parte delle molecole di proteoglicano solo legate non covalentemente all’acido ialuronico in grossi aggregati stabilizzati da proteine leganti specifiche. Il condroitin solfato prevale nel tessuto connettivo compatto (cornea, tendini, derma).
- Il dermatan solfato ha struttura simile al condroitin solfato. Può essere considerato un copolimero di disaccaridi contenendo sia l’acido iduronico sia l’acido glucuronico. Come il condroitin solfato, il dermatan solfato si trova nei tessuti come un proteoglicano.
- I cheratan solfati sono stati distinti in due tipi: il tipo I è localizzato esclusivamente nella cornea; il tipo II si ritrova sempre assieme al condroitin solfato nei proteoglicani dello scheletro.
I cheratan solfati sono più simili alle glicoproteine che ai proteoglicani in quanto è assente l’acido ialuronico e il disaccaride che si ripete (galattosio-glucosamina) è simile a quello trovato in molte glicoproteine. Inoltre, il cheratan solfato contiene acido sialico, fucosio e mannosio (che sono i glucidi riscontrabili nelle glicoproteine).
- L’eparan solfato presenta molti residui di glucosamina N-acetilati e pochi gruppi N-solfati. È un componente ubiquitario della superficie cellulare ed è presente sottoforma di proteoglicano.
- L’eparina è costituita da un’unità di disaccaride composto da glucosamina e un residuo dell’acido uronico; quest’ultimo può essere sia l’acido L-iduronico, sia l’acido D-glucuronico. La maggior parte dei gruppi aminici porta un gruppo N-solfato sebbene una piccola parte dei residui di glucosamina siano N-acetilati.
Il proteoglicano di eparina è formato da diverse catene di eparina legate ad un nucleo proteico. La proteina non è usuale in quanto è formata solo da residui di serina e glicina; almeno i 2/3 dei residui di serina solo legati ai polisaccaridi.
L’eparina ha una localizzazione endocellulare (mastociti e granulociti basofili) da cui può essere rilasciata in risposta a certi stimoli.
I proteoglicani dei tessuti connettivi sono grandi molecole costituite dall’unione di glicosaminoglicani con proteine. I proteoglicani della cartilagine ialina sono costituiti da un asse proteico al quale sono legate covalentemente in punti 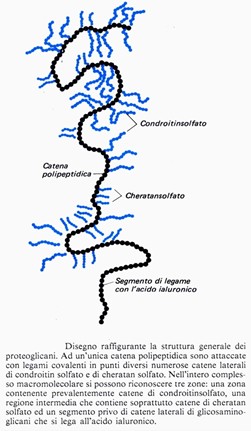 diversi da 60 a 100 catene laterali di GAG solforati appartenenti a tre categorie: condroitin solfato A, condroitin solfato C e cheratan solfato. Queste catene laterali non sono distribuite uniformemente lungo l’asse proteico, ma sono raccolte in gruppi costituiti da 2-8 molecole.
diversi da 60 a 100 catene laterali di GAG solforati appartenenti a tre categorie: condroitin solfato A, condroitin solfato C e cheratan solfato. Queste catene laterali non sono distribuite uniformemente lungo l’asse proteico, ma sono raccolte in gruppi costituiti da 2-8 molecole.
L’asse proteico ha una lunghezza di 100-150 nm e può essere suddiviso in tre regioni:
- Una zona che lega prevalentemente le molecole di condroitin solfato (sempre in corrispondenza di un residuo di serina tramite legame O-glicosidico).
- Una regione intermedia che lega prevalentemente catene di cheratan solfato. Il cheratan solfato corneale è legato alla proteina tramite un legame N-glicosidico tra l’N-acetil-glucosamina e l’asparagina.
Tipi eccezionali di legame sono N-acetil-glalattosamina con treonina, serina o residui idrossilici di serina e N-acetil-galattosamina con serina o treonina ma con legame O-glicosidico. - Un segmento di attacco dell’acido ialuronico che è situato ad un’estremità della molecola ed è privo di catene laterali polisaccaridiche.
Nella matrice cartilaginea la maggior parte dei proteoglicani interagisce a sua volta in corrispondenza della regione di legame dell’acido ialuronico a formare grossi aggregati visibili al microscopio ottico come granuli densi, denominati granuli della matrice, associati alle fibre collagene. Ogni aggregato è formato da un filamento centrale (l’acido ialuronico) dal quale si irradiano lateralmente molti proteoglicani.
I proteoglicani possono interagire mediante legami elettrostatici con il collagene influenzando la morfologia e la funzione delle fibre del connettivo.
I proteoglicani, quando sono aggregati, formano una complicata rete tridimensionale che occupa un volume molto elevato; tale volume è denominato dominio o volume escluso, in quanto da esso è esclusa ogni alta molecola. Il dominio è enorme (400 nm di diametro) e contiene anche acqua ed elettroliti.
La resistenza alla compressione della sostanza intercellulare del tessuto connettivo, oltre che dalle fibre collagene, dipende dal dominio.
Le glicoproteine sono macromolecole contenenti, oltre a proteine, dal 10 al 40% di carboidrati rappresentati da acido sialico, glucosio, mannosio, galattosio, fucosio ed esosamine. Esse si distinguono dai proteoglicani, oltre che per il basso contenuto di esosamine, per la prevalenza della componente proteica (60-90%) su quella glucidica (10-40%).
Le glicoproteine sono costitute da brevi catene oligosaccaridiche (anziché polisaccaridiche) legate con legame O-glicosidico ad un’unica catena polipeptidica, di solito in corrispondenza dei residui di serina o di treonina o con legame N-glicosidico all’asparagina.
Una glicoproteina è la fibronectina costituita da due subunità legate da un ponte disolfuro. Il suo ruolo si pensa sia quello di glicoproeteina adesiva, specifica per gli attacchi delle cellule e materiale extracellulare quale il collagene e i glicosaminoglicani dei diversi proteoglicani. La fibronectina si può trovare localizzata sulla superficie cellulare dove si lega ad uno specifico recettore (integrina) o nella matrice extracellulare; può essere anche presente nel plasma sotto altra forma molecolare.
Il legame della fibronectina al collagene può essere modulato dalla presenza di acido ialuronico, eparina ed eparan solfato.
Un’altra glicoproteina, identificata nella membrana basale, è la laminina, costituita da tre subunità legate da ponti disolfuro a formare una struttura quaternaria a forma di croce latina. Essa è probabilmente prodotta dalle cellule epiteliali e si trova nella lamina lucida della membrana basale. Essa, inoltre, presenta alta affinità per il collagene tipo IV che è componente specifico della membrana basale, presente nella lamina densa. L’interazione laminina-collagene tipo IV sarebbe responsabile dell’organizzazione strutturale della membrana basale e della giunzione tra epitelio e connettivo.
Articolo creato il 01 marzo 2010.
Ultimo aggiornamento: vedi sotto il titolo.