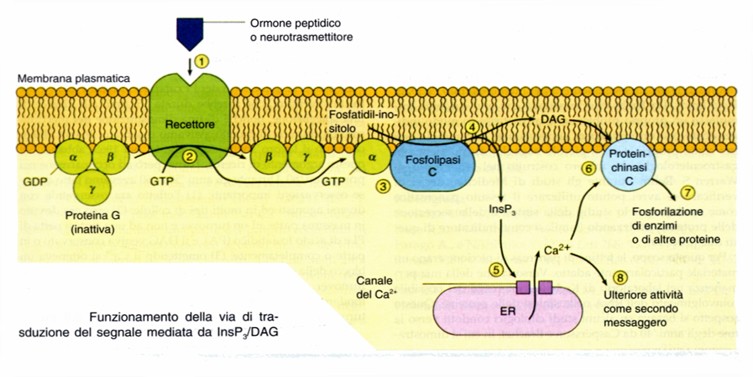
Via della fosfolipasi C
Quando sono attivati recettori accoppiati a proteine Gi e Gq, si attiva l’effettore fosfolipasi C (PLC) che è una fosfodiesterasi. Si conoscono diverse isoforme di fosfolipasi C (PLC): beta, gamma, delta, epsilon (di delta e epsilon sono poco conosciuti i meccanismi di trasduzione). Possiede regioni sia polari che apolari e rimane sospeso nel doppio strato della membrana plasmatica.
- L’isoforma beta, citoplasmatica, è attivata dalla subunità alfaq e dal dimero beta-gamma; alfaq è attivata dall’acetilcolina e dalla noradrenalina.
- L’isoforma gamma è attivata da recettori per i fattori di crescita o dell’insulina. Quando attivati, i recettori vanno incontro a dimerizzazione e si autofosforilano a livello di residui tirosinici.
Questo enzima citoplasmatico agisce sul fosfatidil-inositolo 4,5-difosfato (un fosfolipide di membrana) generando i due secondi messaggeri inositolo-trifosfato (IP3) e diacilglicerolo (DAG).
L’inositolo-trifosfato (IP3) è una molecola relativamente piccola e solubile in acqua che consiste in una unità di inositolo con tre gruppi fosforici. Agisce a livello del citosol surecettori posti sulla membrana del reticolo endoplasmatico, in cui è immagazzinato il calcio, che determinando la fuoriuscita di calcio dai depositi intracellulari; il calcio, in questa via di attivazione, funge da secondo messaggero supplementare. Di conseguenza, questi recettori mediano i loro effetti attraverso un aumento del Ca++ intracellulare.
L’IP3 può anche essere fosforilato ulteriormente a inositolo-tetrafosfato (IP4) che attiva canali al calcio della membrana cellulare favorendo l’ingresso di ioni calcio dall’esterno all’interno della cellula, contribuendo ulteriormente all’aumento della concentrazione citoplasmatica di calcio.
Il calcio rilasciato dall’IP3 può agire direttamente come regolatore cellulare o, in alternativa, può agire in modo indiretto combinandosi con una proteina regolatrice chiamata calmodulina la quale, interagendo con lo ione, passa dalla forma inattiva a quella attiva. Nella forma attiva, il complesso Ca++/calmodulina si lega ad una serie di enzimi e di altre proteine la cui attività è strettamente dipendente da questo complesso. Tra gli enzimi che vengono attivati dal complesso Ca++/calmodulina si trova un gruppo di protein-chinasi le cui proteine bersaglio svolgono un ruolo nel metabolismo cellulare, nella sintesi proteica e nella secrezione. Anche la contrazione della muscolatura striata e l’assemblaggio dei microtubuli sono processi regolati da questo complesso.
Terminata la sua funzione, l’IP3 viene rapidamente defosforilato a inositolo e, a conclusione del ciclo, reinserito in membrana.
Il calcio, invece, viene velocemente eliminato dal citoplasma da pompe Ca++-ATPasi che si trovano nella membrana plasmatica e nel reticolo endoplasmatico.
Il diacilglicerolo (DAG) è un secondo messaggero liposolubile costituito da una molecola di glicerolo con due residui di acido grasso; resta ancorato alla membrana, attiva la protein-chinasi C (PKC) che, a sua volta, catalizza la fosforilazione di varie proteine intracellulari.Ciò determina un aumento di calcio nella cellula che è responsabile di vari effetti: contrazione della muscolatura liscia, secrezione ghiandolare, ecc..
La PKC è costituita da una subunità catalitica ed una subunità regolatrice, che è una calmodulina, cioè una proteina regolata dagli ioni Ca++; quindi sia gli ioni calcio che il DAG contribuiscono all’attivazione della PKC (C = attivata dal Ca++). Come le PKA, le PKC trasferiscono gruppi fosforici in corrispondenza dei residui di serina e di treonina sulle proteine bersaglio. Fanno parte di queste proteine bersaglio: proteine cromosomiche, proteine di trasporto della membrana plasmatica, proteine contrattili e del citoscheletro, proteine che regolano la secrezione e l’endocitosi ed una serie di enzimi che catalizza reazioni ossidative e di altro tipo.
Terminata la sua azione, il DAG viene degradato dalle lipasi in glicerolo e acidi grassi oppure riciclato per la sintesi di lipidi di membrana.
Un altro interruttore per lo spegnimento del segnale è costituito dalle serina/tiroina protein-fosfatasi che staccano specificamente i gruppi fosforici trasferiti sulle proteine dalle protein-chinasi.
Infine, l’attivazione della risposta del recettore si può concludere anche con l’endocitosi dei recettori e delle loro molecole-segnale. Dopo l’endocitosi il recettore può essere degradato dai lisosomi o può essere rimosso dai suoi segnali extracellulari e riciclato sulla superficie cellulare.
Un esempio pratico del meccanismo d’azione di una proteina G mediata dall’effettore PLC è dato dal meccanismo molecolare della contrazione muscolare:
- L’acetilcolina si lega e attiva un recettore accoppiato ad una proteina G con subunità alfaq.
- alfaq-GTP determina l’apertura dei canali del calcio voltaggio-dipendenti.
- Il dimero beta/gamma attiva la PLCbeta che determina produzione di IP3 e DAG che cooperano all’aumento del Ca++ intracellulare.
- Il calcio si lega alla calmodulina (CaM).
- 4 Ca++ si legano ad un sito aspartato-glutammato-asparagina; questo provoca il legame della CaM alla chinasi della catena leggera della miosina (MLCK) che così viene attivata e fosforila la miosina.
- La miosina lega l’actina e avviene la contrazione.
Molti oncogeni (geni normalmente inattivi che, quando attivati, determinano lo sviluppo di tumori) codificano recettori mutati o altri elementi facenti parte del sistema IP3/DAG. L’effetto delle mutazioni è quello di attivare in modo permanente la via dell’IP3/DAG, dando luogo ad una risposta che determina una divisione cellulare rapida e incontrollata, caratteristica delle cellule tumorali.
Articolo creato il 25 febbraio 2010.
Ultimo aggiornamento: vedi sotto il titolo.