Biodisponibilità e bioequivalenza
Tra gli studi in fase di sperimentazione sono effettuati studi sulla biodisponibilità (assoluta) (F), un parametro farmacocinetico che rappresenta la misura della frazione somministrata disponibile per l’azione farmacologica, rispetto alla somministrazione endovenosa di una stessa dose di farmaco.
Ad esempio, la biodisponibilità sarà del 100% quando l’area sottesa alla curva concentrazione plasmatica-tempo, ottenuta dopo somministrazione per via orale, sarà uguale a quella ottenuta dopo sommi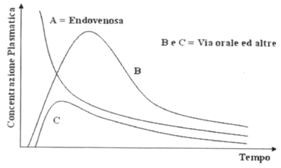 nistrazione di una stessa dose per via endovenosa. Per contro, minore sarà la biodisponibilità per via orale (o per qualunque altra via), maggiore sarà la dose da somministrare al fine di garantire pari efficacia rispetto alla via endovenosa.
nistrazione di una stessa dose per via endovenosa. Per contro, minore sarà la biodisponibilità per via orale (o per qualunque altra via), maggiore sarà la dose da somministrare al fine di garantire pari efficacia rispetto alla via endovenosa.
In via sperimentale si può prevedere se il farmaco per via orale con biodisponibilità diversa dalla somministrazione endovenosa è dovuto al metabolismo o al mancato assorbimento andando a dosare non solo il farmaco, ma anche gli eventuali metaboliti. Se la somma dell’area sottesa alle due curve, metaboliti + farmaco, è uguale all’area sottesa del farmaco somministrato per via endovenosa, allora tale mancata biodisponibilità è dovuta a processi di metabolizzazione; se non ci sono metaboliti è dovuto al mancato assorbimento.
Non potendo andare a misurare la quantità di farmaco sul sito d’azione, si fa riferimento alla concentrazione plasmatica in quanto c’è un parallelismo tra l’andamento della concentrazione plasmatica e l’andamento del farmaco effettivo biodisponibile.
Inoltre, la determinazione della concentrazione del farmaco nel tempo si può misurare nelle urine.
Della quantità di farmaco che viene somministrata, solo una parte sarà responsabile dell’azione farmacologica perché non tutto il farmaco somministrato viene assorbito in quanto può essere modificato tramite processi di metabolizzazione (ad esempio a livello del fegato).
La misurazione della biodisponibilità è effettuata col calcolo dell’area sottesa alla curva concentrazione plasmatica-tempo (AUC).
Somministrando un farmaco per via endovenosa si ha una biodisponibilità massima del 100%, dato che tutto il farmaco che si somministra si ritrova nel torrente circolatorio (curva A); in questa curva manca la fase d’ascesa perché, per definizione, l’assorbimento è il passaggio del farmaco dalla sede di somministrazione al torrente circolatorio; se s’inietta il farmaco direttamente in circolo, la fase di assorbimento risulta bypassata.
Quando si somministra il farmaco tramite una via in cui c’è l’assorbimento, invece, ci possono essere dei fattori e delle situazioni in cui parte del farmaco o non viene assorbito o viene metabolizzato; si avrà, quindi, una biodisponibilità che potrà essere diversa dalla biodisponibilità somministrando lo stesso farmaco alla stessa concentrazione per via endovenosa (curve B e C).
Non si studia solo l’area sottesa alla curva che indica solo la quantità di farmaco disponibile. Bisogna considerare anche altri parametri che sono il picco di concentrazione massima e il tempo per raggiungere il picco di concentrazione massima; lo studio, quindi, non è solo quantitativo ma anche qualitativo.
L’ampiezza del picco massimo indica la massima intensità dell’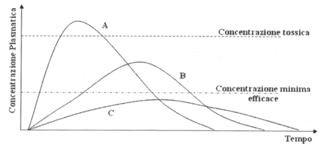 effetto. Considerando un sistema di assi cartesiani con il tempo in ascisse e la concentrazione plasmatica del farmaco in ordinata, le curve seguenti rappresentano l’assorbimento del farmaco. Ciascuna avrà un picco massimo al quale corrisponderà un effetto di intensità massimo che decadrà nel tempo per processi di metabolizzazione ed allontanamento del farmaco dal torrente circolatorio ad altri distretti dell’organismo. Gli effetti che si ottengono con questo tipo di andamento della concentrazione plasmatica saranno diversi a seconda dei casi.
effetto. Considerando un sistema di assi cartesiani con il tempo in ascisse e la concentrazione plasmatica del farmaco in ordinata, le curve seguenti rappresentano l’assorbimento del farmaco. Ciascuna avrà un picco massimo al quale corrisponderà un effetto di intensità massimo che decadrà nel tempo per processi di metabolizzazione ed allontanamento del farmaco dal torrente circolatorio ad altri distretti dell’organismo. Gli effetti che si ottengono con questo tipo di andamento della concentrazione plasmatica saranno diversi a seconda dei casi.
Nel caso A si avrà un andamento molto rapido dell’effetto farmacologico, tanto da ottenere un effetto tossico; nel caso B la manifestazione dell’effetto sarà ritarda, con la concentrazione minima efficace anch’essa ritardata; nel caso C non si raggiungerà la concentrazione sufficiente ad avere un effetto terapeutico.
Viene definita biodisponibilità relativa la biodisponibilità di una formulazione farmaceutica rispetto a quella di una formulazione di riferimento, somministrata alla stessa dose e per la stessa via.
Se due forme farmaceutiche diverse (ad esempio, compresse e capsule) o la stessa forma farmaceutica ma formulata in maniera diversa con eccipienti diversi ma contenenti la stessa quantità di principio attivo danno lo stesso tipo di effetto, sono bioequivalenti. Valutando la biodisponibilità sulla base delle curve concentrazione plasmatica-tempo, due formulazioni sono considerate bioequivalenti se non differiscono significativamente per quanto riguarda i seguenti parametri: area sottesa alla curva concentrazione plasmatica-tempo (AUC), picco di concentrazione massima (Cmax) e tempo di raggiungimento del picco (Tmax). Formulazioni bioequivalenti possono essere usate l’una in sostituzione dell’altra senza alcuna conseguenza clinica rilevante (sia in termini di efficacia che in termini tossici).
Articolo creato il 28 febbraio 2010.
Ultimo aggiornamento: vedi sotto il titolo.


