Recettori metabotropici glutammatergici (o del glutammato)
Oltre a recettori ionotropici del glutammato (iGlu), esistono recettori metabotropici glutammatergici (o del glutammato, mGlu) che, a differenza dei primi che sono responsabili della trasmissione sinaptica eccitatoria, fungono da modulatori della sinapsi glutammatergica, in quanto reclutati solo in condizioni di elevate concentrazioni extracellulari del neurotrasmettitore.
Si conoscono 8 sottotipi di mGlu (mGlu1-8) suddivisi in tre gruppi in base all’omologia di sequenza, al profilo farmacologico e ai meccanismi di trasduzione del segnale.
- Al I gruppo appartengono i recettori mGlu1 e mGlu5. Essi sono localizzati prevalentemente a livello postsinaptico dove la loro funzione è quella di rinforzare la trasmissione glutammatergica durante fenomeni di plasticità (apprendimento, memoria e coordinazione motoria), interagendo con i recettori iGlu e con i canali ionici. Inoltre, modulano positivamente il rilascio di glutammato e negativamente (mGlu1a) il rilascio di GABA (o acido g-amino-butirrico).
Sono recettori di tipo eccitatorio e, quando espressi in sistemi eterologhi, esplicano la loro funzione mediante l’accoppiamento di una proteina Gq/11 che attiva una fosfolipasi Cβ (PLCβ) con conseguente produzione di inositolo-trifosfato (IP3) e diacilglicerolo (DAG), responsabili del rilascio intracellulare di calcio e dell’attivazione di protein-chinasi C (PKC); inoltre, essi attivano i canali del calcio di tipo L e di tipo N e inibiscono i canali del potassio coinvolti così i canali ionici inducendo aumento dell’eccitabilità neuronale.
Questi recettori sono in grado anche di attivare la fosfolipasi A2 con formazione di acido arachidonico, la fosfolipasi D, e le MAPK (ERK1/ERK2) facilitando l’espressione genica.
I recettori del I gruppo potenziano la funzione dei recettori ionotropici del glutammato sia con meccanismo mediato dalla protein-chinasi C (rimozione del blocco da magnesio dei recettori NMDA) che con meccanismo indipendente dalle proteine G, attivando tirosin-chinasi non recettoriali della famiglia Src, che determinano un’aumentata fosforilazione del recettore NMDA e del recettore AMPA, potenziandone così le correnti.
- Al II gruppo appartengono i recettori mGlu2 e mGlu3. Essi hanno localizzazione prevalentemente presinaptica e svolgono un ruolo di tipo inibitorio sulla sinapsi glutammatergica, riducendo il rilascio di glutammato solo durante i processi di ipereccitabilità neuronale, mentre non intervengono in caso di trasmissione sinaptica eccitatoria normale.
Il recettore mGlu2 è inoltre localizzato sui terminali di neuroni GABAergici dove controlla in senso inibitorio il rilascio di GABA fungendo da eterorecettore.
I recettoro mGlu3 si possono trovare anche a livello postsinaptico, ma sono espressi primariamente dalle cellule gliali (negli astrociti si localizzano sul versante endoteliale dove possono essere raggiunti anche dal glutammato circolante).
Questi recettori sono accoppiati a proteine Gi o Go ed inibiscono l’adenilato-ciclasi determinando una riduzione dei contenuti intracellulari di AMP-ciclico, quando espressi in sistemi eterologhi (meccanismo sensibile alla tossina della pertosse).
Anch’essi intervengono nella modulazione dei canali ionici, soprattutto canali del calcio di tipo L e N, che vengono inibiti. Tale meccanismo è di fondamentale importanza nel processo di inibizione del rilascio di neurotrasmettitore dai terminali presinaptici.
Inoltre, questi recettori attivano i canali del potassio, determinando iperpolarizzazione di membrana; entrambi gli effetti sui canali determinano riduzione dell’eccitabilità neuronale.
Infine, attraverso la subunità βgdella proteina G, attivano le vie della MAPK e della PI-3-chinasi, mediante le quali mediano i loro effetti neuroprotettivi ed antiapoptotici.
Tutte queste funzioni sono condivise dai recettori metabotropici del glutammato del III gruppo.
- Al III gruppo appartengono i recettori mGlu6, mGlu7 e mGlu8. Anch’essi un controllo inibitorio sui livelli di glutammato extracellulare e sono prevalentemente presinaptici. I recettori del III gruppo sono inoltre presenti sui terminali di neuroni GABAergici dove svolgono il ruolo di eterorecettori.
L’unica localizzazione del recettore mGlu6 è nelle cellule bipolari ON della retina.
Questi recettori sono accoppiati a proteine Gi o Go ed inibiscono l’adenilato-ciclasi determinando una riduzione dei contenuti intracellulari di AMP-ciclico, quando espressi in sistemi eterologhi (meccanismo sensibile alla tossina della pertosse).
Anch’essi intervengono nella modulazione dei canali ionici, soprattutto canali del calcio di tipo L e N, che vengono inibiti. Tale meccanismo è di fondamentale importanza nel processo di inibizione del rilascio di neurotrasmettitore dai terminali presinaptici.
Inoltre, questi recettori attivano i canali del potassio, determinando iperpolarizzazione di membrana; entrambi gli effetti sui canali determinano riduzione dell’eccitabilità neuronale.
Infine, attraverso la subunità βγ della proteina G, attivano le vie della MAPK e della PI-3-chinasi, mediante le quali mediano i loro effetti neuroprotettivi ed antiapoptotici.
Tutte queste funzioni sono condivise dai recettori metabotropici del glutammato del II gruppo.
I recettori metabotropici del glutammato sono anche espressi in organi periferici quali cuore, timo, pancreas, fegato, intestino, osso testicoli, cute (in melanociti, cheratinociti e terminali nocicettivi afferenti) e papille gustative.
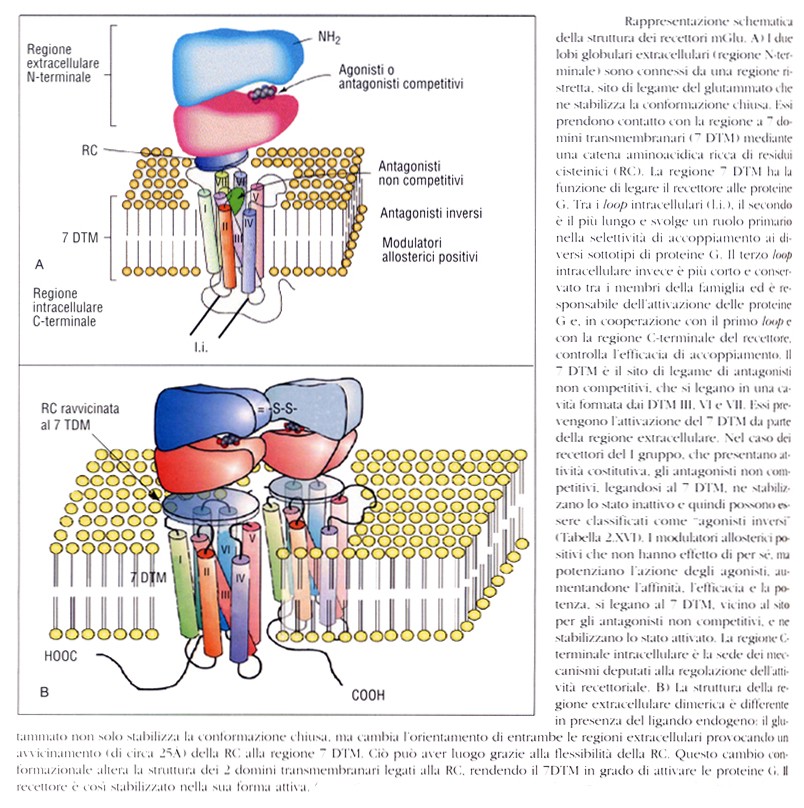
I recettori metabotropici del glutammato sono recettori di membrana costituiti da una larga porzione N-terminale extracellulare di circa 600 aminoacidi, da 7 domini transmembranari connessi da 3 anse (o loop) extracellulari e 3 anse intracellulari, e da una porzione C-terminale intracellulare (di lunghezza variabile).
La regione N-terminale ha una struttura globulare bilobata che costituisce i 2/3 distali della porzione extracellulare e si presenta in una configurazione “aperta” in assenza di ligando e “chiusa” in sua presenza. Il glutammato, infatti, si lega sul solco formato dai due lobi e, mediante legami con residui aminoacidici di entrambi i lobi, ne determina l’avvicinamento e la chiusura attorno ad esso; la conformazione chiusa viene così stabilizzata. La struttura bilobata, oltre a riconoscere i ligando endogeno, è anche sede del legame di agonisti e antagonisti competitivi.
Alla base della struttura globulare è presente una catena di circa 70 aminoacidi, ricca di residui cisteinici, che la connette alla regione transmembranaria.
I 7 domini transmembranari hanno il compito di accoppiare il recettore a proteine G ed è anche sede di legame di antagonisti non competitivi e di modulatori allosterici positivi e, nel caso di sottotipi dotati di attività costitutiva (mGlu1 e mGlu5), di agonisti inversi.
La regione C-terminale presenta siti di fosforilazione, importanti per la regolazione dell’attività recettoriale, ed è inoltre bersaglio di proteine citoplasmatiche, il cui legame determina il corretto inserimento del recettore nella membrana plasmatica, la specifica localizzazione in varie sedi del neurone, l’interazione con altri recettori di membrana e, nel caso dei recettori mGlu del I gruppo, controlla l’attività costitutiva del recettore.
Tutti i sottotipi sono organizzati a formare delle strutture dimeriche (omodimeri) stabilizzate da legami disolfuro, necessarie per il funzionamento del recettore.
I recettori del I gruppo vanno incontro a desensitizzazione omologa dopo prolungata esposizione all’agonista, mediante un processo di fosforilazione indotto dalla protein-chinasi C su siti localizzati a livello della regione C-terminale; ciò altera l’accoppiamento del recettore con la proteina Gq/11.
La calmodulina (attivata dal calcio) è in grado di prevenire la desensitizzazione legandosi al sito di fosforilazione della PKC. Anche le chinasi GRK fosforilano e desensitizzano i recettori del I gruppo, ma con un meccanismo agonista-dipendente, determinando il sequestro e l’internalizzazione del recettore; inoltre, le proteine Gq interagiscono direttamente con le proteine RGS2/4 che ne bloccano la funzione.
La fosforilazione di questi recettori può determinare l’accoppiamento dei recettori a proteine G inibitorie, provocando una riduzione del rilascio di glutammato che rappresenta un freno dell’eccitabilità neuronale.
Infine, le isoforme lunghe delle proteine Homer hanno la capacità di dimerizzare e così di connettere i recettori mGlu fra loro, con i recettori per l’IP3, con i canali del calcio di tipo N, con i canali del potassio di tipo M, con i recettori NMDA, e di regolarne l’attività costitutiva. Questi effetti vengono revertiti dalla Homer 1a (isoforma corta) che, indotta dall’attività sinaptica, funge da dominante negativo nei confronti delle isoforme lunghe (costitutive).
I recettori del II e III gruppo vanno incontro a desensitizzazione per effetto della protein-chinasi C e della protein-chinasi A, che ne fosforilano la regione C-terminale, provocando il distacco della proteina G. gli effetti mediati dalla PKA possono derivare anche dall’attivazione di altri recettori, come i β-adrenergici.
Articolo creato il 24 ottobre 2010.
Ultimo aggiornamento: vedi sotto il titolo.